





Nature Biomedical Engineering |王育才教授团队开发一氧化氮靶向调控技术,实现肿瘤血管基底膜时空特异性降解与重塑,增强纳米药物肿瘤递送
近日,生物医学工程学院王育才教授课题组在《Nature Biomedical Engineering》在线发表题为《Enhanced nanoparticle delivery across vascular basement membranes of tumours using nitric oxide》的研究论文。该研究聚焦于限制纳米药物递送效率的关键障碍—肿瘤血管基底膜屏障,提出利用一氧化氮(NO)精准空间催化降解的策略,通过特异性调控肿瘤相关内皮细胞,实现基底膜屏障的高效突破,从而显著提升纳米药物在肿瘤组织内的递送效率。
工程化纳米颗粒作为药物载体在肿瘤治疗中展现出广阔的应用前景。然而,尽管多种设计优化策略已被报道,纳米颗粒实际到达肿瘤的比例依然很低,仅约为注射总量的0.7%。造成递送效率受限的主要原因在于,纳米颗粒在体内递送过程中需连续跨越多重的生理屏障。其中,结构复杂的肿瘤血管是主要屏障之一,纳米颗粒需首先跨越血管屏障,方能实现深入的组织渗透与有效药物递达。因此,高效突破血管屏障是实现纳米颗粒肿瘤靶向治疗的关键前提。传统观点普遍将血管屏障等同于内皮屏障,并主要依赖“增强渗透与滞留效应(EPR effect)”解释纳米颗粒进入肿瘤的机制。然而,纳米颗粒在肿瘤组织中富集效率极低,提示除内皮之外,可能还存在其他关键限制性因素。王育才教授课题组在前期的研究中,发现位于内皮外侧的基底膜,是限制纳米颗粒跨血管转运进入肿瘤组织的重要屏障(Nature Nanotechnology 2024, 19, 95-105)。该结构呈连续致密网状结构,显著阻碍纳米颗粒的跨血管转运。然而,突破基底膜屏障面临三重挑战:其一,基底膜位于内皮外侧,位置隐匿,纳米颗粒需先跨过内皮细胞,方可精准定位到基底膜;其二,基底膜由高度交联的胶原网状结构组成,机械强度高,对常规治疗手段具有抵抗性;其三,基底膜的完整性在维持血管稳态和抑制肿瘤转移中发挥重要作用,若破坏过度,可能引发转移风险。因此,开发一种精准、可控且可逆的基底膜调控策略,对于提高纳米颗粒跨血管递送效率,具有重要意义。
在血管新生过程中,基底膜的降解与重塑是驱动内皮细胞迁移与新生血管形成的关键环节,其中,一氧化氮(NO)正是调控该过程的重要信号分子。受此生理过程启发,该研究提出以NO作为调控手段,实现肿瘤血管基底膜的可控降解与重塑,从而提升纳米颗粒的跨血管转运效率(图1)。该工作发现,NO可诱导内皮细胞间粘附连接短暂打开,从而暴露出外侧的基底膜结构,并在局部迅速形成纳米颗粒富集的“血池”区域。进一步研究表明,NO可激活血池周围内皮细胞中的基质金属蛋白酶(MMP),在空间上形成限域的酶促反应区域,从而实现对血池外围基底膜的局部、可控降解。在此机制作用下,纳米颗粒在高MMP酶活性区域呈现出“动态喷发式”的外渗行为,显著提升其在肿瘤组织中的渗透深度与渗透面积。该空间特异性机制在增强血管渗透性的同时,有效避免了基底膜的广泛破坏,降低了潜在的肿瘤转移风险。
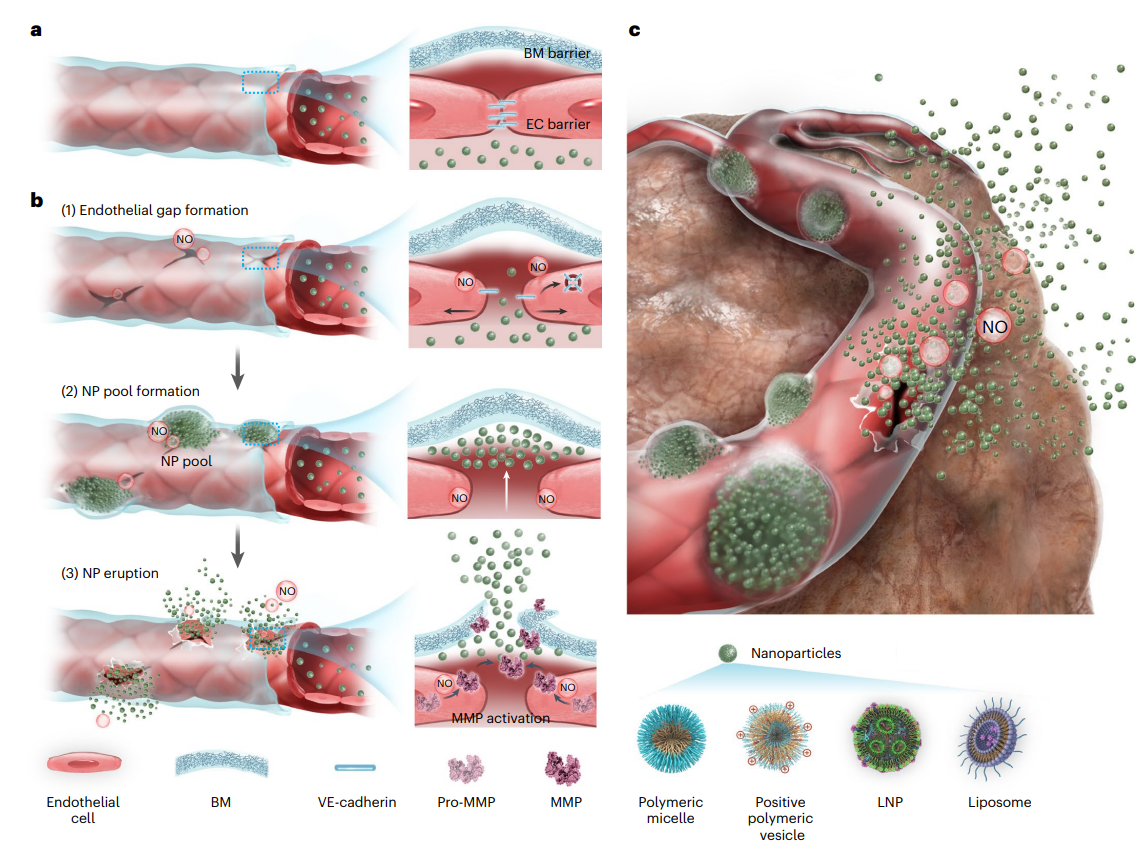
图1、利用NO突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送。
尽管NO在调控基底膜屏障方面展现出独特优势,其在肿瘤中的靶向应用仍面临释放速率控制、系统性副作用及特异性递送等挑战。为此,该研究构建了近红外光触发按需释放NO NO型的NanoNO系统,作为概念验证平台。NanoNO以上转换纳米粒子(UCNP)为核心,外层修饰聚乙二醇并锚定N-亚硝胺类NO供体。在980 nm激光照射下,UCNP发射的UV-Vis光激活NOD,实现NO的精准释放。在4T1乳腺癌肿瘤模型中,NanoNO可诱导大量“血池”形成,并伴随时间推移产生“动态喷发式”外渗行为,持续促进纳米颗粒向肿瘤深层渗透,从而显著增强纳米药物的治疗效果。例如,在联合临床常用的脂质体阿霉素(Lipo DOX)时,NO干预使肿瘤抑制率显著提升至94–96%;此外,该策略亦明显增强了mRNA脂质纳米颗粒在肿瘤中的积累,显示出良好的平台通用性,也为核酸类药物在实体瘤中的高效递送提供了新的解决方案。
综上,该研究在纳米药物递送领域取得了进展:一方面,揭示了基底膜作为关键非内皮屏障在药物递送中的屏障作用,并提出NO作为一种临床可行手段用于基底膜屏障的调控,可用于增强在研及已上市药物的肿瘤递送效率,为其临床转化及应用提供可能。另一方面,阐明了NO对血管结构及其生物学反应的调控机制,诱导空间靶向性基底膜降解,促进纳米药物高效跨血管转运与深部组织递送。该策略有望拓展应用于多种药物类型,包括蛋白药物、抗体、疫苗及细胞治疗,展现出良好的适应性与推广潜力。未来或可发展为一种通用、高效的精准递送平台,用于应对多类受基底膜屏障限制的疾病治疗需求。
中国科学技术大学蒋为副研究员、郭子萱博士、汪沁博士为该论文共同第一作者,中国科学技术大学王育才教授、安徽大学刘航副教授为本文共同通讯作者;团队其他成员及合作者也为本研究做出了重要贡献。
论文链接https://www.nature.com/articles/s41551-025-01385-w